Бензойная кислота ее химическое поведение. Реферат: Бензойная кислота
Кислота бензойная
Химические свойства
Данное вещество – одноосновная карбоновая кислота ароматического ряда. Рацемическая формула Бензойной Кислоты: C7H6O2 . Структурная формула: C6H5COOH . Впервые была синтезирована еще в 16 веке из росного ладана, бензойной смолы, откуда и получила свое название. Это белые мелкие кристаллы, которые плохо растворяются в воде, хорошо растворимы в хлороформе , этаноле и диэтиловом эфире . Молекулярная масса вещества = 122,1 грамм на моль.
Химические свойства Бензойной Кислоты. Вещество проявляет слабые кислотные свойства, достаточно легко возгоняется и перегоняется с помощью водяного пара. Вступает во все реакции, характерные для карбоксильной группы. Реакция нитрования (HNO3 ) протекает сложнее, чем электрофильное ароматическое присоединение в 3-ем положении. При введении заместителя, например, алкила , легче происходит замещение во второй позиции. Химическое соединение образует эфиры , амиды , бензойный ангидрид , галогенангидриды , ортоэфиры , соли.
Качественная реакция на Бензойную Кислоту. Чтобы установить подлинность вещества проводят реакцию с хлоридом железа 3, FeCl3 , в результате образуется плохо растворимый в воде комплексный основной бензоат железа 3 , обладающий характерной желто-розовой окраской.
Получение из толуола . Чтобы Бензойную Кислоту получить из толуола, необходимо воздействовать на средство сильным окислителем, например, MnO2 в присутствии катализатора – серной к-ты . В результате образуется вода и ионы Mn2+ . Также толуол можно окислить . Для того, чтобы провести реакцию получения Бензойной Кислоты из бензола сначала необходимо получить толуол : бензол + CH3Cl , в присутствии хлорида алюминия = толуол + . Также при получении вещества используют реакции гидролиза бензамида и бензонитрила ; реакцию Канниццаро или реакцию Гриньяра (карбоксилирование фенилмагнийбромида ).
Применение вещества:
- для калибровки калориметров, используется в качестве теплового стандарта;
- сырье для получения бензоилхлорида , бензоатных пластификаторов;
- в качестве консерванта, в чистом виде или в виде натриевых, кальциевых и калиевых солей, код E210 , E212 , E211 , E213 ;
- при некоторых кожных заболеваниях и в качестве отхаркивающего средства (натриевая соль);
- в парфюмерной промышленности используют эфиры кислоты;
- нитро- и хлорбензойная кислота используется при синтезе красителей.
Фармакологическое действие
Антисептическое, противогрибковое.
Фармакодинамика и фармакокинетика
Бензойная Кислота обладает способностью блокировать ферменты и замедлять обменные процессы в грибковой клетке и в некоторых одноклеточных микроорганизмах. Предотвращает рост дрожжевых грибов, плесени и вредоносных бактерий. Через микробную клетку проникает недиссоциированная кислота, при кислом рН .
Безопасная дозировка вещества для человека составляет 5 мг на кг веса в сутки. Средство присутствуют в моче млекопитающих животных, как составная часть гиппуровой кислоты .
Показания к применению
Применяют в составе различных препаратов от , трихофитии ; для комплексного лечения ожогов и незаживающих ран; при лечении трофических язв и пролежней , .
Противопоказания
Индивидуальная непереносимость.
Побочные действия
Бензойная Кислота редко вызывает побочные реакции, может ощущаться жжение и зуд в месте нанесения. Симптомы проходят со временем самостоятельно. Редко наблюдаются аллергические реакции.
Инструкция по применению (Способ и дозировка)
Препараты с добавлением Бензойной Кислоты используют наружно. Кратность применения зависит от заболевания и концентрации вещества. Препараты наносят на пораженные участки кожи, на раневые поверхности, по показания – под марлевую повязку. Лечение, как правило, продолжают до полного заживления.
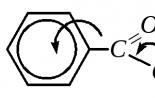
Карбоксильная группа в молекуле бензойной кислоты оказывает по отношению к ароматическому кольцу электроноакцепторные индуктивный и мезомерный эффекты (аналогия со строением бензальдегида - гл. 10.8.2). Электронная плотность на кольце понижена, особенно во- и п- положениях. В сопряжение вовлекается и атом кислорода O H -группы, в связи с чем вся молекула имеет плоское строение.
10.9.3. Физические и химические свойства
Ароматические карбоновые кислоты представляют собой белые кристаллические вещества, некоторые из них обладают приятным запахом.
Важнейшими свойствами самих карбоновых кислот (ароматических так же, как и алифатических) и в ряде случаев таких их производных, как амиды, являются их кислотно-основные свойства. При этом оснóвные свойства незначительны и практического значения не имеют.
Так же, как и для алифатических аналогов, для ароматических кислот и их производных характерны реакции в ацильной группе, приводящие к получению одних производных из других.
Ещё одним важным свойством этих соединений являются реакции по бензольному кольцу, что характерно для всех ароматических производных.
10.9.3.1. Кислотные свойства
Кислотные свойства алифатических карбоновых кислот рассматривались ранее (гл. 6.4.4.1). Для ароматических карбоновых кислот кислотность связана также с возможностью отрыва катиона водорода от карбоксильной группы. При этом аренмонокарбоновые кислоты относятся к слабым O H -кислотам. Бензойная кислота лишь ненамного сильнее уксусной (рК а для бензойной равна 4.17 против 4.76 для уксусной). Лучше всего это можно объяснить возможностью более полной делокализации отрицательного заряда аниона кислотного остатка с участием -электронной системы бензольного кольца.

Поэтому так же, как и в случаях с аренсульфокислотами (гл. 10.3.3.4) и фенолами (гл. 10.5.3.1), электроноакцепторные заместители будут увеличивать кислотные свойства, а электронодонорные, наоборот, - уменьшать.

Однако для некоторых заместителей, находящихся в орто -положении бензольного кольца по отношению к карбоксильной группе, влияние на кислотные свойства аренкарбоновых кислот не ограничивается индуктивным и мезомерным эффектами (и пространственным эффектом тоже). Это так называемый орто-эффект , проявляющийся во взаимодействии карбоксильной и находящейся к ней в о -положении р -донорной группы за счёт внутримолекулярных водородных связей. Примером проявления орто -эффекта является взаимодействие функциональных групп в молекуле салициловой кислоты, увеличивающее её кислотность по сравнению с бензойной (рК а = 3.00) за счёт увеличения полярности О–Н -связи в карбоксильной группе и стабилизации образующегося аниона:

салициловая кислота
Это характерно также для антраниловой (о -аминобензойной) кислоты, для фталевой (о -бензолдикарбоновой кислоты) и аналогичных по структуре о -замещённых бензойных кислот.
В целом арендикарбоновые и аренполикарбоновые кислоты являются более сильными, чем монокарбоновые (сказывается акцепторное влияние второй карбоксильной группы).
Значимыми кислотными свойствами обладают также амиды и имиды некоторых кислот. Например, фталимид является типичной (хотя и слабой) N H -кислотой (рК а = 8.3):

Он растворяется в водных щелочах (солеобразование с последующим гидролизом). Поэтому для получения стабильных солей их синтезируют в безводной среде.
Соли фталимида (например, фталимид калия) нашли применение в получении чистых первичных аминов (синтез Габриэля *):

Первая стадия здесь - взаимодействие галогеналкана с фталимидом калия, являющимся нуклеофилом, - типичная реакция S N в ряду галогеналканов. За ней следует гидролиз образовавшегося N - алкилфталимида, который обычно проводят в солянокислой среде.
10.9.3.2. Реакции в ацильной группе
Ранее на примере алифатических аналогов (гл. 6.4.4.2) рассматривались реакции нуклеофильного замещения в карбоксильной группе карбоновых кислот и в ацильных группах производных этих кислот. При этом из одних ацильных производных образуются другие ацильные производные.

Возможен и кислотный катализ.

Скорость реакции зависит от пространственных факторов, величины заряда на карбонильном атоме углерода и природы уходящей группы (её основности). Таким образом, реакционная способность ароматических карбоновых кислот и их производных уменьшается в том же ряду, что и их алифатических аналогов:
Для аренкарбоновых кислот характерны также реакции декарбоксилирования, начинающиеся с нуклеофильной атаки по карбонильному атому углерода (гл. 6.4.4.4).
10.9.3.3. Электрофильное замещение
Как следует из строения бензойной кислоты, карбоксильная группа оказывает электроноакцепторное влияние на бензольное кольцо, в связи с чем уменьшает электронную плотность на кольце и направляет вступающий электрофил преимущественно в мета- положение. Это можно показать граничными формулами распределения электронной плотности в исходной молекуле бензойной кислоты:

Из S E -реакций для аренкарбоновых кислот (и их ацильных производных) характерны реакции нитрования, сульфирования и галогенирования. Например:

Вещество имеет условное обозначение Е210 и обязано своему наименованию бензойной смоле, из которой была впервые выделена около пяти столетий назад.
Обладает противомикробным действием, а в прошлом веке её начали широко использовать в медицине и для консервирования разнообразных продуктов. Об этом веществе и будет рассказано в , а также о его применении в наши дни.
Свойства бензойной кислоты
Основные свойства и её структура были исследованы в XIX веке. На вид консервант представляет из себя кристаллический порошок, который можно безошибочно отличить от других по характерному запаху.
В воде бензойная кислота растворяется плохо (лишь 0,3 грамма кристаллического порошка на стакан).
Поэтому, в случае необходимости, используют обычно . Но бензойная растворима в не содержащем воды этиловом спирте, кроме того в таких веществах, как жиры, и легко получить её раствор в составе 100 г масла и 2 г Е210.
При температуре 122,4 °C порошка плавятся, а при 249 °C вещество закипает. Формула бензойной кислоты имеет вид: C 6 H 5 СООН.
Вещество классифицируется, как одноосновная ароматического ряда. Е210 активно реагирует с белками.
Чтобы провести химическую реакцию на качество Е210 и солей бензойной кислоты , в пробирку насыпают немного бензойной и капают небольшое количество 10%-го раствора NaOH.
Отличить по химическим характеристикам бензойную от бензоата натрия достаточно легко. Проще всего это сделать с помощью лакмусовой .
Если она , то это бензоат натрия , бензойная кислота даёт реакцию, поэтому бумажка .
Вещество безвредно для человека и прекрасно выводится из его организма, в который поступает с продуктами питания, косметическими средствами и медикаментами.
Однако, при его употреблении с продуктами, содержащими абрикосовую , образуется опасный для жизни бензол, вредно влияющий на работу печени и почек. Поэтому употребление консерванта в продуктах питания строго дозируется.
Кошки в реакции на Е210 во многом отличаются от своих хозяев. Для них дневная норма потребления должна составлять не более сотых долей миллиграмма.
Это говорит о том, что домашних питомцев лучше не кормить консервами и продуктами, содержащими бензойную .

Попадая в организм человека Е210 способствует производству в нём крайне необходимого витамина В10.
Это очень ценное свойство, потому что в случае нехватки этого вещества, могут возникнуть очень серьёзные проблемы и развиться неприятные заболевания.
У человека при недостатке бензойной может появиться раздражительность и слабость, а также депрессия и головные боли.
Применение бензойной кислоты
Вещество ценно тем, что снижает активность ферментов в структуре микробов, убивая их, чем и объясняются её дезинфицирующие свойства.
Это качество нашло активное применение бензойной кислоты и с успехом используется для изготовления лекарственных составов от кашля, отхаркивающих и антисептических средств, а также специальных препаратов, называемых фунгицидами, применяющимися в сельском хозяйстве для защиты разнообразных культурных растений.
Эффективно и широко используется и для лечения кожных заболеваний. Убивая грибки, вещество прекрасно способствует устранению различных грибковых инфекций.
Оно прекрасно борется с потливостью ног. Для эффективного действия делают серию ванн с добавлением кристаллов Е210, и подобные дают самые положительные результаты.
Препараты, изготовленные из Е210 могут помочь при болезнях (низкой свёртываемости или сгущении).
Они прекрасно помогают кормящим материм, значительно активизируя лактацию и повышая качество грудного молока.

Лекарства, имеющие в составе бензойную , показаны детям, у которых наблюдается замедление роста, помогая устранить подобные недостатки в развитии . Препараты из Е210 выписываются врачами также больным анемией.
Бензойная кислота , салициловая , вазелин – являются группой средств, которые в комбинации обладают многими полезными свойствами.
Из них производятся кремы, мази и лосьоны, которые прекрасно излечивают болезненные кожные наросты и мозоли.
Успешно используют бензойную кислоту в косметике . Она входит в состав действенных средств для лечения волос и служит необходимой основой для состава полезных лекарственных препаратов, предохраняющих волосяной покров головы от ломкости и выпадения.
Практически все средства для омоложения и устранения проблем кожи содержат бензойную .
Е210 добавляют в состав мазей, которые прекрасно избавляют от чесотки. Она используется для производства дезодорантов и духов.
Применяется вещество и в химической промышленности, как эффективный и сильный реагент при синтезе многочисленного вида органических веществ.
Свойства консерванта неоценимы в кулинарии, успешно используются в хлебопекарнях и кондитерских.
Без него немыслимо приготовление многих видов овощных и растительных солений, фруктовых и ягодных варений, маринование некоторых видов мяса и рыбы, а также производство маргарина и заменителей , полезных для больных диабетом.
Без этой не было бы сладких конфет, вкусных ликёров, особых приправ, множества разновидностей мороженного и ароматных жевательных .
Эфиры бензойной кислоты успешно применяются для стабилизации пластмасс, что является важной частью процесса в изготовлении изделий технического назначения и детских .
Получение бензойной кислоты
Впервые были выделены из бензойной смолы. В природе, в результате жизнедеятельности микробов, вещество получается при разложении гиппуровой и образуется естественным образом в простоквашах и йогуртах, других кисломолочных продуктах.
Оно содержится также в гвоздичном масле, а в природе встречается в составе ягод брусники, черники и клюквы.

В прежние времена для получения бензойной кислоты использовали метод гидролиза с применением различных катализаторов.
Но на сегодняшний день этот способ потерял свою актуальность. Самым выгодным и распространённым современным методом производства является синтез в результате окисления толуола.
Процесс замечателен тем, что не заражает окружающую среду вредными веществами, а используемое сырьё является достаточно дешёвым. Из вещества выделяются такие примеси, как бензиловый спирт, бензил бензоат и другие.
Цена бензойной кислоты
Бензойную кислоту купить можно свободно. Для этого не требуется документов. И продаётся она, как юридическим, так и любым физическим лицам.
Для совершения такой сделки следует найти в своём городе, по стране или за рубежом подходящую фирму, занимающуюся продажей реактивов.
Такие предприятия и компании могут работать по наличному, а в некоторых случаях, по безналичному расчёту.
Вещество также можно приобрести в химических лабораториях практически задаром.
Целесообразно искать выгодные предложения с фотографиями, адресами, описаниями и отзывами в .
В сети также можно узнать о предложениях о продаже оптом ароматических бензойных .
Кристаллический порошок Е210 можно приобрести килограммами и фасованным в мешках, вес которых обычно составляет 25 кг.

От качества продукта зависит цена, которая колеблется от 74 до 150 руб./кг по .
На импортную обычно более высокие цены, доходящие до 250 руб./кг. Порошок бензойной кислоты из Румынии и Голландии продают по цене 105 руб./кг.
Бензойная , фасованная в мешках, продаётся по цене в пределах от 650 до 1350 руб. за мешок.
Вещество такого качества предназначено для медицинских целей и может быть применено в роле антисептика, как противогрибковое и антибактериальное средство.
Бензойная кислота известна человечеству очень давно. Первые упоминания об этом веществе относятся к шестнадцатому веку. Именно тогда ученым впервые удалось выделить бензойную кислоту из одноименной смолы методом сублимации. А в девятнадцатом веке немецкие химики исследовали это соединение более детально и сравнили свойства бензойной кислоты со свойствами гиппуровой кислоты. Противомикробное и противогрибковое действие бензойной кислоты послужило причиной того, что в двадцатом веке ее начали использовать в качестве пищевого консерванта при производстве продуктов питания.
Физические и химические свойства бензойной кислоты
Своим внешним видом бензойная кислота напоминает тонкие продолговатые листочки или иголочки белого цвета с характерным блеском. Она очень хорошо растворяется практически в любой среде: в жирах, спиртах и в обычной воде. Кроме того, при температуре свыше 122 градусов по Цельсию бензойная кислота расплавляется и переходит в газообразное состояние.
Любой химик скажет вам, что это соединение относится карбоновым одноосновным кислотам ароматического ряда. Но нам больше интересно, каковы свойства бензойной кислоты, и не наносит ли она вреда человеческому здоровью. На этикетках продуктов питания она обозначается кодом Е210. В промышленных масштабах бензойную кислоту производят из толуола, методом окисления последнего. Раньше ее получали из фталевой кислоты или бензотрихлорида, но сейчас этот способ не актуален в силу дороговизны и сложности технологического процесса.
Что касается безопасности и натуральности, то бензойную кислоту можно назвать природным соединением, поскольку она присутствует в составе некоторых ягод (черники, брусники, клюквы), а также образуется в кисломолочных продуктах, таких, как йогурты или простокваша. Это не значит, что ее там так же много, как в некоторых консервированных продуктах заводского производства. Но, с другой стороны, это свидетельствует о том, что бензойная кислота не токсична и не опасна для человека, если употреблять ее в разумных количествах.
Применение бензойной кислоты
Консервант Е210 активно используется пивоваренной, кондитерской и хлебопекарной промышленностью. Вот неполный список продуктов, выпускаемых с применением бензойной кислоты:
- Фруктовые соки и пюре;
- Варенья, джемы и повидла;
- Молочные продукты;
- Овощные консервы;
- Мороженое;
- Ликеры, пиво, вина;
- Конфеты и сахарозаменители;
- Соленая и маринованная рыба;
- Маргарин и масло;
- Жевательная резинка.
Влияние бензойной кислоты на здоровье
Когда бензойная кислота попадает в наш организм, она вступает в реакцию с белковыми молекулами и трансформируется в гиппуровую кислоту, а уже потом выводится наружу вместе с мочой. Разумеется, этот процесс представляет собой лишнюю нагрузку на выделительную систему, поэтому российским законодательством установлена предельно допустимая норма использования бензойной кислоты при производстве продуктов питания. Ее не должно быть больше, чем 5 миллиграммов на 1 килограмм готового продукта.
Но о вреде бензойной кислоты обычно рассуждают не в контексте нагрузки на почки. Дело в том, что при определенных условиях из этого химического соединения может образовываться чистый бензол – опасное вещество, относящееся к канцерогенам, то есть провоцирующее развитие онкологических заболеваний. Но чтобы произошла такая реакция, необходима очень высокая температура. В организме человека выделение бензола из бензойной кислоты невозможно. Однако греть консервированные продукты, не предназначенные для этого, и употреблять их в таком виде не рекомендуется.
Некоторые современные специалисты в области пищевой химии полагают, что при взаимодействии бензойной кислоты Е210 и аскорбиновой кислоты Е300 возможно возникновение нежелательных химических реакций с выделением бензола. Но для этого процесса также требуется особая среда с повышенной температурой. В любом случае, вы можете узнать из этикетки, есть ли такое сочетание веществ в конкретном продукте, и принять решение, покупать его или нет.
Любителям кошек следует помнить, что для ваших питомцев бензойная кислота и ее соли крайне опасны сами по себе, даже в мизерных количествах. Поэтому прежде чем предлагать своей кошке какой-либо продукт со своего стола, убедитесь, что в его составе нет такого консерванта. Вообще это одна из многих причин, почему не стоит кормить домашних любимцев «человеческими» продуктами. Лучше покупать специальное питание или готовить для них пищу самим.
Популярные статьи Читать больше статей
 02.12.2013
02.12.2013
Все мы много ходим в течение дня. Даже если у нас малоподвижный образ жизни, мы все равно ходим – ведь у нас н...
608232 65 Подробнее
 10.10.2013
10.10.2013
Пятьдесят лет для представительниц прекрасного пола – это своеобразный рубеж, перешагнув который каждая вторая...
448971 117 Подробнее
Кислота бензойная содержится во многих плодах и ягодах. Но для медицинских целей её получают окислением толуола различными окислителями (азотная или хромовая кислота, калия дихромат, диоксид марганца ) в кислой среде .
Современный промышленный способ основан на жидкофазном окислении толуола кислородом воздуха при 130-160 о С и давлении 308-790 кПа .


Натрия бензоат получают, выпаривая досуха раствор соответствующей бензойной кислоты, нейтрализованный эквивалентным количеством Nа 2 СО 3 (натрия карбоната)
Описанне
Кислота бензойная – бесцветные игольчатые кристаллы или белый мелкокристаллический порошок, без запаха. При нагревании возгоняется, перегоняется с водяным паром.
Натрия бензоат – белый кристаллический или аморфный порошок без запаха или с очень слабым запахом.
Растворимость
Кислота мало растворима в воде (растворима в кипящей), легко растворяется в этаноле, эфире.
Натриевая соль легко растворима в воде, трудно в спирте, не растворима в эфире.
Подлинность
1. ФС УФ-спектр водного раствора натрия бензоата в области 220-300 нм должен иметь максимум поглощения при 226±2 нм.
2. ФС. Реакция солеобразования с солями тяжелых металлов (с FеСl 3 ). Реакция на бензоат-ион. Кислоту предварительно переводят в натриевую соль. Проводится в нейтральной среде, т.к. в кислой среде осадок комплексной соли растворяется (поэтому кислоту предварительно растворяют в 0,1н NаОН), а в щелочной – выпадает бурый осадок Fе(ОН) 3 .
Эффект реакции - образование труднорастворимой комплексной соли железа окрашенной в розовато-желтый цвет (телесный цвет).
С 6 Н 5 СООН + NаОН → C 6 H 5 COONa + Н 2 О (до нейтральной рН)
бензойная кислота экв.
6C 6 H 5 COONa + 2FеСl 3 + 10Н 2 О →
→ (С 6 Н 5 СОО -) 3 Fе 3+ · Fе(ОН) 3 · 7Н 2 О ↓ + 3С 6 Н 5 СООН + NаСl
осадок розовато-желтого цвета
3. ФС температура плавления бензойной кислоты . В натрия бензоате её получают, обработав препарат азотной кислотой, определяют температуру плавления выпавшей в осадок бензойной кислоты.
C 6 H 5 COONa + HNO 3 → C 6 H 5 COOН ↓ + NaNO 3
4.ФС Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет (катион натрия).
Не фармакопейные реакции :
5. с Н 2 О 2 в присутствии катализатора Fе S О 4 из бензойной образуется салициловая кислота и последующее добавление FеСl 3 вызывает появление фиолетового окрашивания, а не розовато-желтого.


6. С CuS O 4 в нейтральной среде образуется осадок соли меди сине-зеленого цвета . При последующем добавлении хлороформа, слой хлороформа окрашивается в голубой цвет, водный – обесцвечивается (экстракция продукта реакции, т.к. неполярное соединение).
2C 6 H 5 COONa + CuSО 4 → (C 6 H 5 COO -) 2 Сu 2+ ↓ + Nа 2 SО 4
осадок сине-зелёноro цвета
7. В нейтральной среде при добавлении к раствору А gNO 3 образуется осадок белого цвета . C 6 H 5 COOАg↓.
-
 Опорная функция скелета заключается в том, что он является опорой для мышц и внутренних органов, которые, фиксируясь к костям, удерживаются в своем положении Строение рост костей скелет человека
Опорная функция скелета заключается в том, что он является опорой для мышц и внутренних органов, которые, фиксируясь к костям, удерживаются в своем положении Строение рост костей скелет человека
-
 Реферат: Бензойная кислота
Реферат: Бензойная кислота
-
 Своеобразие философского учения джидду кришнамурти Самые известные книги учителя
Своеобразие философского учения джидду кришнамурти Самые известные книги учителя
-
 Знаменитые мумии и их загадочные истории
Знаменитые мумии и их загадочные истории